浓溶液和稀溶液怎么区分啊!
这个没有明确的界线。就硫酸,硝酸经常用到,通常浓溶液都是给十几摩每升的
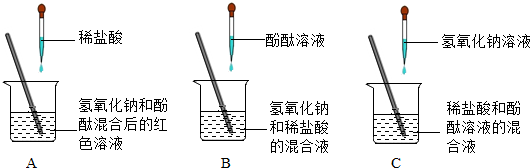
化学中浓溶液和稀溶液是如何区分的
化学中稀溶液和浓溶液区分是通过质量分数或者浓度来判断的,往往物质不同,那么对应溶液的稀或浓的判断标准不一样,例如硫酸的质量分数超过70%为浓溶液,硝酸则为65%。
溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。物质在常温时有固体、液体和气体三种状态。因此溶液也有三种状态,大气本身就是一种气体溶液,固体溶液混合物常称固溶体,如合金。一般溶液只是专指液体溶液。液体溶液包括两种,即能够导电的电解质溶液和不能导电的非电解质溶液。所谓胶体溶液,更确切的说应称为溶胶。其中,溶质相当于分散质,溶剂相当于分散剂。在生活中常见的溶液有蔗糖溶液、碘酒、澄清石灰水、稀盐酸、盐水、空气等。
溶液:一种或一种以上的物质以分子或离子形式分散于另一种物质中形成的均一、稳定的混合物。
组成成分:
1.溶质:被溶解的物质(例如:用盐和水配置盐水盐就是溶质)
2.溶剂:能溶解其他物质的物质(例如:用盐和水配置盐水'水就是溶剂)
3.两种溶液互溶时,一般把量多的一种叫溶剂,量少的一种叫溶质。
溶液性质:
1.均一性:溶液各处的密度、组成和性质完全一样;
2.稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离(透明);
3混合物:溶液一定是混合物。
溶液分类:
饱和溶液:在一定温度、一定量的溶剂中,溶质不能继续被溶解的溶液。
不饱和溶液:在一定温度、一定量的溶剂中,溶质可以继续被溶解的溶液。
饱和与不饱和溶液的互相转化:
不饱和溶液通过增加溶质(对一切溶液适用)或降低温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则须升高温度,如石灰水)、蒸发溶剂(溶剂是液体时)能转化为饱和溶液。
饱和溶液通过增加溶剂(对一切溶液适用)或升高温度(对于大多数溶解度随温度升高而升高的溶质适用,反之则降低温度,如石灰水)能转化为不饱和溶液。
为什么浓溶液的性质与稀溶液的有不同
影响化学反应的因素除了物质本身的结构外,还有物质的量、排列方式、状态(固液汽)、反应环境等。以上任何因素都可以左右反应的发生情况。
浓稀溶液就是物质的量不同、粒子排列疏密不同,所以有所区别。
请例举说明是饱和溶液也是稀溶液;是不饱和溶液也是稀溶液;是饱和溶?
在20℃时,100g水中最多能溶解0.00024gBaSO4,此时所得溶液显然很稀,但它却是饱和溶液;
怎么判断浓溶液与稀溶液?
一般认为10mol/L以上的是浓溶液,10mol/L以下的就是稀溶液.
如浓硫酸,18mol/L
在题目中遇到3mol/L的盐酸就是稀盐酸,与MnO2就不能反应生成氯气了没有固定的.
18mol/L的H2SO4是浓硫酸,3mol/L的HCl是稀盐酸.
够了么..? 溶液的浓稀是相对的,没有相对参照物,不能确定溶液的浓稀,只能确定溶液的浓度。对在0摄氏度,放10g食盐在100g水中,全部溶解和在30摄氏度,放38g食盐在100g水中进行比较:
在0摄氏度,放10g食盐在100g水中,全部溶解。相对在30摄氏度,放38g食盐在100g水中,未全部溶解是稀溶液;反之在30摄氏度,放38g食盐在100g水中,未全部溶解相对在0摄氏度,放10g食盐在100g水中,全部溶解,是浓溶液我们所说溶液的稀、浓其实是指单位质量的溶液中含有溶质质量的多少,含溶质多就是浓溶液,少就是稀溶液!
所以溶液的稀、浓在知识上就是质量分数决定的,质量分数越大,溶液越浓;质量分数越小,溶液越稀!
由于物质不同,溶解度不同;就是同种物质,温度不同,物质溶解度也不同。溶解度不同,造成最大质量分数不同!
因此不能简单比较溶液的浓或稀!!必须计算出质量分数才能比较!
考试常考的类型:
比如:1.KNO3的饱和溶液比他的不饱和溶液浓(错,由于不知道温度,温度不同,溶解度不同,所以不能确定他们的浓或稀!)
2.20度时,氢氧化钙的饱和溶液比10度时的不饱和溶液浓(错。由于氢氧化钙溶解度随温度升高反而降低,所以20度时,氢氧化钙的饱和溶液肯定比10度时的饱和溶液稀。但10度时的不饱和,就不能判断浓或稀)
3.10g食盐加入100g水中比20gKNO3加入100g水稀(错。温度没有确定,不知道他们的溶解度,万一KNO3只溶解5g,而食盐全部溶解呢?)
。。。。。
所以不能简单比较浓或稀!!!再说浓或稀是相对而言的,10%和20%比,10%是稀,20%是浓;但20%和30%比,20%是稀。。。。。
不过你题上的可以判断他们的浓或稀
因为食盐溶解度基本不随温度改变,而且大约是30g.所以0度和30度的溶解度相差不大!
所以10g食盐在100g水中肯定全部溶解。38g食盐在100g水中至少溶解30g以上
所以w=10/110=9.1%,30/130=23%
所以肯定是后面的浓!!!前面的稀!我们先来确认两个概念:
溶解度:在一定条件下(温度、压力,等),熔剂能够溶解溶质的量。
浓度:熔剂中,所含溶质的比例。
可以看出:溶解度的有条件的,而浓度是无条件的。
楼主的问题是“比较浓度的高低”而不是比较“溶解的程度是否饱和”或者“饱和到了什么程度”。
“放10g食盐在100g水中,全部溶解”,浓度(质量比)是10/(10+100)=1/11。
“放38g食盐在100g水中,未全部溶解”,不能计算浓度。除非查溶解度表。
所以,两者不能通过计算来比较浓度的高低。尽管我们可以肯定后者比前者的浓度高,但不能定量地说高多少。
以上是通过计算来比较浓度的高低。
浓度还可以这样比较:
将不同浓度的溶液(溶质、熔剂均相同)缓慢降温,在同一条件下,先析出溶质的溶液浓度高。
不同的溶质,就只能通过计算进行比较。
在你的问题中,“放38g食盐在100g水中,未全部溶解”,我们知道:在30℃的时候,食盐肯定比在10℃的时候溶解的多,所以,后者肯定比前者浓。倒不是因为它是饱和溶液。
试想,在10℃的时候,我们配成饱和溶液(甲溶液),然后将温度升高5℃,再加一点点食盐,又配成饱和溶液。再升高温度5℃,到20℃(乙溶液),肯定不饱和了。我们将甲乙两种食盐溶液让两个人喝,难道说,喝乙溶液的食盐浓度更低吗?当然下面的浓,食盐的溶解度随温度的上升而增大。所以“在30摄氏度,我放38g食盐在100g水中,未全部溶解”的溶解量绝对大于10克,比“在0摄氏度,我放10g食盐在100g水中,全部溶解”浓在0摄氏度,我放10g食盐在100g水中,全部溶解。形成的溶液稀
在30摄氏度,我放38g食盐在100g水中,未全部溶解。形成的溶液浓
浓和稀是与溶质有关的,只不过因为温度的原因没有完全溶解,这是因为饱和的关系你是初中生吧?
我们所说溶液的稀、浓其实是指单位质量的溶液中含有溶质质量的多少,含溶质多就是浓溶液,少就是稀溶液!
所以溶液的稀、浓在知识上就是质量分数决定的,质量分数越大,溶液越浓;质量分数越小,溶液越稀!
由于物质不同,溶解度不同;就是同种物质,温度不同,物质溶解度也不同。溶解度不同,造成最大质量分数不同!
因此不能简单比较溶液的浓或稀!!必须计算出质量分数才能比较!
考试常考的类型:
比如:1.KNO3的饱和溶液比他的不饱和溶液浓(错,由于不知道温度,温度不同,溶解度不同,所以不能确定他们的浓或稀!)
2.20度时,氢氧化钙的饱和溶液比10度时的不饱和溶液浓(错。由于氢氧化钙溶解度随温度升高反而降低,所以20度时,氢氧化钙的饱和溶液肯定比10度时的饱和溶液稀。但10度时的不饱和,就不能判断浓或稀)
3.10g食盐加入100g水中比20gKNO3加入100g水稀(错。温度没有确定,不知道他们的溶解度,万一KNO3只溶解5g,而食盐全部溶解呢?)
。。。。。
所以不能简单比较浓或稀!!!再说浓或稀是相对而言的,10%和20%比,10%是稀,20%是浓;但20%和30%比,20%是稀。。。。。
不过你题上的可以判断他们的浓或稀
因为食盐溶解度基本不随温度改变,而且大约是30g.所以0度和30度的溶解度相差不大!
所以10g食盐在100g水中肯定全部溶解。38g食盐在100g水中至少溶解30g以上
所以w=10/110=9.1%,30/130=23%
所以肯定是后面的浓!!!前面的稀!
化学反应中浓稀溶液的不同
浓稀硝酸与金属反应,产物不同,浓生NO2,稀生NO,浓硫酸可制挥发性酸,稀不行。浓NAOH溶液与硫反应稀不行。化学中 怎样将稀 溶液变成浓溶液
化学中稀溶液和浓溶液区分是通过质量分数或者浓度来判断的,往往物质不同,那么对应溶液的稀或浓的判断标准不一样,例如硫酸的质量分数超过70%为浓溶液,硝酸则为65%。





