过氧化氢分解的化学方程式
过氧化氢分解的化学方程式:
2H₂O₂==2H₂O+O₂(等号上写催化剂)
过氧化氢化学式为H₂O₂,俗称双氧水。外观为无色透明液体,是一种强氧化剂,其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会分解成水和氧气,但分解速度极其慢,加快其反应速度的办法是加入催化剂——二氧化锰或用短波射线照射。
水溶液为无色透明液体,溶于水、醇、乙醚,不溶于苯、石油醚。
纯过氧化氢是淡蓝色的粘稠液体,熔点-0.43°C,沸点150.2°C,纯的过氧化氢其分子构型会改变,所以熔沸点也会发生变化。凝固点时固体密度为1.71g/,密度随温度升高而减小。它的缔合程度比H₂O大,所以它的介电常数和沸点比水高。纯过氧化氢比较稳定,加热到153°C便猛烈的分解为水和氧气,值得注意的是,过氧化氢中不存在分子间氢键。
过氧化氢对有机物有很强的氧化作用,一般作为氧化剂使用。
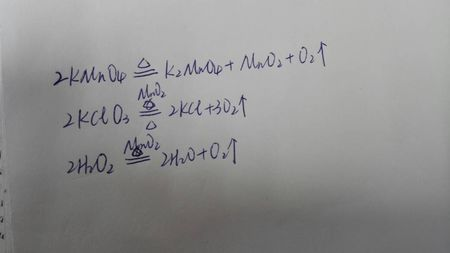
过氧化氢化学表达式是什么?
过氧化氢化学表达式是H₂O₂。
过氧化氢的水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会缓慢分解成水和氧气,但分解速度极其慢。
过氧化氢化学式为HO。过氧化氢的水溶液为无色透明液体,溶于水、醇、乙醚,不溶于苯、石油醚。纯过氧化氢是淡蓝色的粘稠液体,熔点-0.43°C,沸点150.2°C,纯的过氧化氢其分子构型会改变,所以熔沸点也会发生变化。
凝固点时固体密度为1.71g/cm,密度随温度升高而减小。它的缔合程度比H2O大,所以它的介电常数和沸点比水高。
1.氧化性。
2.还原性:和氯气、高锰酸钾等强氧化剂反应被氧化生成氧气。
3.在10%试样液10mL中,加稀硫酸试液(TS-241)5mL和高锰酸钾试液(TS-193)1mL。应有气泡发生,且高锰酸钾的紫红色消失。对石蕊呈酸性。遇有机物易爆。
4.遇有机物、受热分解放出氧气和水,遇铬酸、高锰酸钾、金属、碳酸反应剧烈。为了防止分解,可以加入微量的稳定剂,如锡酸钠、焦磷酸钠等等。
5.纯过氧化氢很不稳定,加热到153°C便猛烈的分解为水和氧气。
过氧化氢与亚硫酸铁反应方程式
酸性条件下反应:
H2O2 + 2 FeSO4 + H2SO4 === Fe2(SO4)3 + 2 H2O
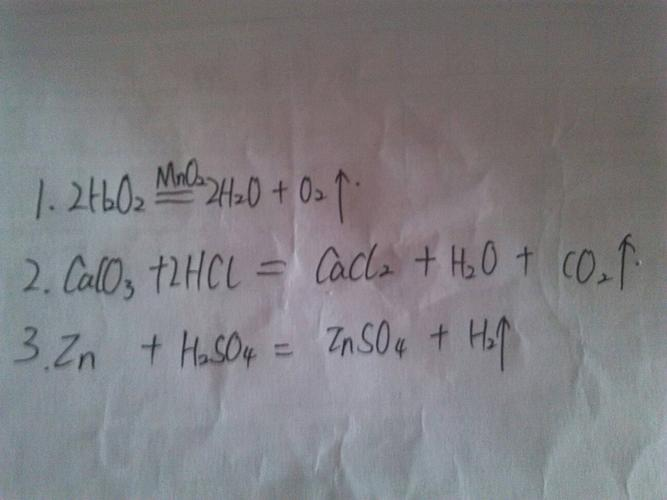
请问氢溴酸与过氧化氢混合反应方程式是什么?
反应方程式:2HBr+H2O2Br2+2H2O,该反应放热,要注意控制其温度
过氧化氢的化学方程式
2是小下标。
过氧化氢溶液也叫双氧水。有杀菌的作用。H2O2过氧化氢的溶液即是双氧水,其化学式是H2O2(2是下标)氢2氧2焦亚硫酸钠又称重硫氧,分子式na2s205,分子量109.10,白色或微黄色结晶,相对密度1.4。受潮易分解,露置于空气中易氧化为硫酸钠,与强酸接触放出二氧化硫而生成相应的盐类,加热到150 ℃分解。溶于水,水溶液呈酸性。溶于甘油,微溶于乙醇。无毒。
用作乳液防冻剂,也可用作防腐剂、漂白剂。贮存于阴凉、干燥的库房内,密闭。不宜久贮。
我只知道这些中文名称:过氧化氢
英文名称: hydrogen peroxide
中文名称2: 双氧水
商品编码:28470000无任何监管条件 增值税17% 退税13%
CAS No.: 7722-84-1
分子式: H2O2
分子量: 34.01
主要成分: 工业级 分为27.5%、35%两种。
外观与性状: 无色透明液体,有微弱的特殊气味。
熔点(℃): -2(无水)
沸点(℃): 158(无水)
相对密度(水=1): 1.46(无水)
饱和蒸气压(kPa): 0.13(15.3℃)
溶解性: 溶于水、醇、醚,不溶于苯、石油醚。
主要用途: 用于漂白,用于医药,也用作分析试剂。
健康危害:吸入本品蒸气或雾对呼吸道有强烈刺激性。眼直接接触液体可致不可逆损伤甚至失明。口服中毒出现腹痛、胸口痛、呼吸困难、呕吐、一时性运动和感觉障碍、体温升高等。个别病例出现视力障碍、癫痫样痉挛、轻瘫。长期接触本品可致接触性皮炎。
燃爆危险: 本品助燃,具强刺激性。
危险特性:爆炸性强氧化剂。过氧化氢本身不燃,但能与可燃物反应放出大量热量和氧气而引起着火爆炸。过氧化氢在pH值为3.5~4.5时最稳定,在碱性溶液中极易分解,在遇强光,特别是短波射线照射时也能发生分解。当加热到 100℃以上时,开始急剧分解。它与许多有机物如糖、淀粉、醇类、石油产品等形成爆炸性混合物,在撞击、受热或电火花作用下能发生爆炸。过氧化氢与许多无机化合物或杂质接触后会迅速分解而导致爆炸,放出大量的热量、氧和水蒸气。大多数重金属(如铁、铜、银、铅、汞、锌、钴、镍、铬、锰等)及其氧化物和盐类都是活性催化剂,尘土、香烟灰、碳粉、铁锈等也能加速分解。浓度超过74%的过氧化氢,在具有适当的点火源或温度的密闭容器中,能产生气相爆炸。
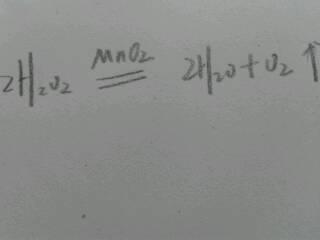
过氧化氢相关的化学方程式
过氧化氢是非常强的氧化剂
1、氧化性:
H2O2+ 2KI + 2HCl ==== 2KCl + I2+ 2H2O
2Fe2+ + H2O2+ 2H+ ==== 2Fe3+ + 2H2O
H2O2+ H2S ==== S↓+ 2H2O
H2O2+ SO2==== H2SO4
注:在酸性条件下H2O2的还原产物为H2O,在中性或碱性条件其还原产物为氢氧化物。
2、还原性:
2KMnO4+ 5H2O2+ 3H2SO4==== 2MnSO4+ K2SO4 + 5O2↑+ 8H2O
2KMnO4+ 3H2O2==== 2MnO2+ 2KOH + 3O2↑+ 2H2O
H2O2+ Cl2==== 2HCl + O2
注:H2O2的氧化产物为O2
3、不稳定性
过氧化氢在常温可以发生分解反应生成氧气和水(缓慢分解),在加热或者加入催化剂后能加快反应,催化剂有二氧化锰、硫酸铜、碘化氢、二氧化铅、三氯化铁,及生物体内的过氧化氢酶等
2H2O2==MnO2== 2H2O + O2↑
2H2O2 ==Δ== 2H2O + O2↑
4、电解反应
电解过氧化氢会生成臭氧和水,同时水又生成氢气和氧气。
分步反应化学方程式:
一、3H2O2==电解== 3H2O + O3↑
二、2H2O ==电解== 2H2↑ + O2↑
总反应化学方程式为:
6H2O2==电解==6H2↑ + 2O3↑ + 3O2↑
注:首次生成的臭氧颜色为橙黄。
5、分解反应
2H2O2==MnO2== 2H2O + O2↑
更详细的请看百度百科:过氧化氢





