为什么计算水中碱度要用0.5的碳酸钙的摩尔质量
因为每个碳酸钙在与酸反应时只需用一个氢离子,而一个氢离子对应一个氢氧根离子。所以平时计算水中碱度就统一用0.5浓度的碳酸钙的摩尔量来计。
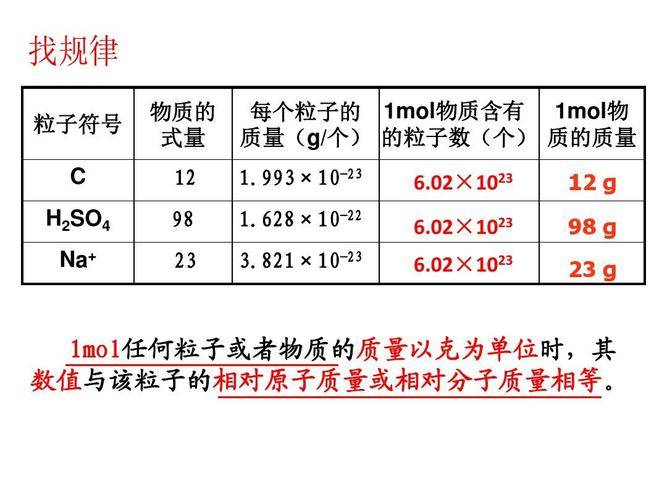
CaCO3的mol质量是多少?
CaCO3的摩尔质量是100g/mol
(摩尔质量等于相对分子质量,Ca:40,C:12,O:16,CaCO3:40+12+3*16==100)
摩尔质量可以等于摩尔乘质量吗
单位物质的量的物质所具有的质量,称为摩尔质量(molar mass),用符号M表示。当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量。对于某一纯净物来说,它的摩尔质量是固定不变的,而物质的质量则随着物质的物质的量不同而发生变化。

什么是摩尔质量?如何计算摩尔质量?
②它以阿伏加德罗数为计量单位,是个批量,不是以个数来计量分子、原子等微粒的数量。也可以用于计量微观粒子的特定组合,例如,用摩尔计量硫酸的物质的量,即1mol硫酸含有6。02×10的23次方个硫酸分子。摩尔是化学上应用最广的计量单位,如用于化学反应方程式的计算,溶液中的计算,溶液的配制及其稀释,有关化学平衡的计算,气体摩尔体积及热化学中都离不开这个基本单位。
1mol碳酸钙(CaCO3)的质量为()克,10克碳酸钙为()mol。
物质的量(mol)已经超初中范围了
”物质的量”是一种物理量,可以理解成粒子数目的比值
简单地讲,1mol是0.012kg碳-12的粒子数目(约等于6.023乘以10的23次方,也就是1mol物质有”6.023乘以10的23次方”32313133353236313431303231363533e4b893e5b19e31333236393830个粒子)(这个简单了解一下就可以了,高一会学的)
它的公式为 物质的量=质量/相对原子质量 (质量单位;克)
可以推导出 质量=物质的量*相对原子质量
这里讲下你写在正文里的那道题,上题解法一样的
只要掌握解法就行了
题目中4mol二氧化碳可用公式推算
质量=物质的量*相对原子质量 =(4mol)*(44g/mol)=176g
(物质的量)(相对原子质量)
13.2克二氧化碳同理
物质的量=质量/相对原子质量=(13.2g)/(44g/mol)=0.3mol
氧原子物质的量:
因为二氧化碳化学式为CO2
即一个CO2分子有2个氧原子
因为计算得二氧化碳物质的量为0.3mol
所以二氧化碳的粒子数目为(0.3mol)*(6.023乘以10的23次方,简写为NA)=0.3NA
又因为一个CO2分子有2个氧原子
氧原子物质的量为0.3NA*2=0.6NA
这些知识初中都是不必要的
高一一上来就会学这些
现在还是好好复习初中科学吧
这道题目稍稍了解一下就行了碳酸钙的摩尔质量为100,所以10mol碳酸钙1000g
10除以100=0.1
所以10g碳酸钙为0。1mol盐酸的总量为0.2500mol/l*25ml=6.25mmol
naoh消耗的盐酸为5.84ml*0.2012mol/l=1.175008mmol
两者之差就为caco3消耗的盐酸,得6.25-1.175=5.075mmol.
一分子的caco3消耗两分子的盐酸(如果只消耗一分子的话并不产生co2),
于是caco3物质的量为5.075mmol/2=2.5375 mmol
caco3分子量为:100.09。得100.09mol/g*2.5375 mmol=253.978mg=0.2540g
最后结果:0.2540g/0.3000g=0.8467=84.67%呵呵…这是高中的知识…176克(4*44) 0.3mol(13.2/44) 3.72*10^23(10的二十三次方)(6.02*10^23*0.3*2)

1mol碳酸钙(CaCO3)的质量为()克,10克碳酸钙为()mol。
物质的量(mol)已经超初中范围了
”物质的量”是一种物理量,可以理解成粒子数目的比值
简单地讲,1mol是0.012kg碳-12的粒子数目(约等于6.023乘以10的23次方,也就是1mol物质有”6.023乘以10的23次方”32313133353236313431303231363533e4b893e5b19e31333236393830个粒子)(这个简单了解一下就可以了,高一会学的)
它的公式为 物质的量=质量/相对原子质量 (质量单位;克)
可以推导出 质量=物质的量*相对原子质量
这里讲下你写在正文里的那道题,上题解法一样的
只要掌握解法就行了
题目中4mol二氧化碳可用公式推算
质量=物质的量*相对原子质量 =(4mol)*(44g/mol)=176g
(物质的量)(相对原子质量)
13.2克二氧化碳同理
物质的量=质量/相对原子质量=(13.2g)/(44g/mol)=0.3mol
氧原子物质的量:
因为二氧化碳化学式为CO2
即一个CO2分子有2个氧原子
因为计算得二氧化碳物质的量为0.3mol
所以二氧化碳的粒子数目为(0.3mol)*(6.023乘以10的23次方,简写为NA)=0.3NA
又因为一个CO2分子有2个氧原子
氧原子物质的量为0.3NA*2=0.6NA
这些知识初中都是不必要的
高一一上来就会学这些
现在还是好好复习初中科学吧
这道题目稍稍了解一下就行了碳酸钙的摩尔质量为100,所以10mol碳酸钙1000g
10除以100=0.1
所以10g碳酸钙为0。1mol盐酸的总量为0.2500mol/l*25ml=6.25mmol
naoh消耗的盐酸为5.84ml*0.2012mol/l=1.175008mmol
两者之差就为caco3消耗的盐酸,得6.25-1.175=5.075mmol.
一分子的caco3消耗两分子的盐酸(如果只消耗一分子的话并不产生co2),
于是caco3物质的量为5.075mmol/2=2.5375 mmol
caco3分子量为:100.09。得100.09mol/g*2.5375 mmol=253.978mg=0.2540g
最后结果:0.2540g/0.3000g=0.8467=84.67%呵呵…这是高中的知识…176克(4*44) 0.3mol(13.2/44) 3.72*10^23(10的二十三次方)(6.02*10^23*0.3*2)





