实验室制取氨气的化学方程式
实验室制备氨气:
2NH4Cl+Ca(OH)2====CaCl2+2NH3+2H2O
工业合成氨:
N2+3H2======2NH3
以上是最常用的,其实还有其他方法的:
①铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,试管要向下倾斜。
②在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:
NH3+H2O
NH3·H2O
NH4++OH-加入碱平衡左移,同时放出大量的热促进氨水的挥发。
③加热浓氨水,加快氨水挥发。
希望对你有帮助哦,新年快乐天天开心哦,如果有帮助就采纳一下吧^^
实验室制氨气的方程式
氢氧化钙固体和氯化铵晶体混合加热
Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+H2O(加热)
浓氨水滴到生石灰上(快速制备)
NH3.H2O+CaO=NH3↑+Ca(OH)2
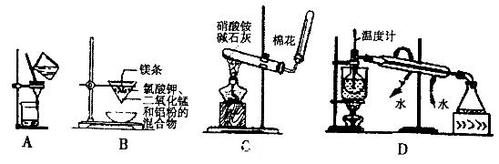
实验室制氨气实验室制法中,收集氨气的试管为何要用棉花塞住
1是防止空气进入,是氨气不纯净
2是防止氨气泄露
实验室制氨气为什么不能用浓硫酸干燥气?实验室制氨气为什么不能用浓
氨气会和硫酸溶液反应生成硫酸铵
实验室制氨气的方程式
N2+3H2=2NH3工业
实验室:2NH4CL+CA(OH)2=CACL2+2NH3+2H2O加热氢氧化钙固体和氯化铵晶体混合加热
ca(oh)2+2nh4cl=cacl2+2nh3↑+h2o(加热)这是实验室常规的制法,固固加热型
浓氨水滴到生石灰上(快速制备)
nh3.h2o+cao=nh3↑+ca(oh)2 也可以,固液不加热型
浓氨水加热分解,那就是方法三了。加油!
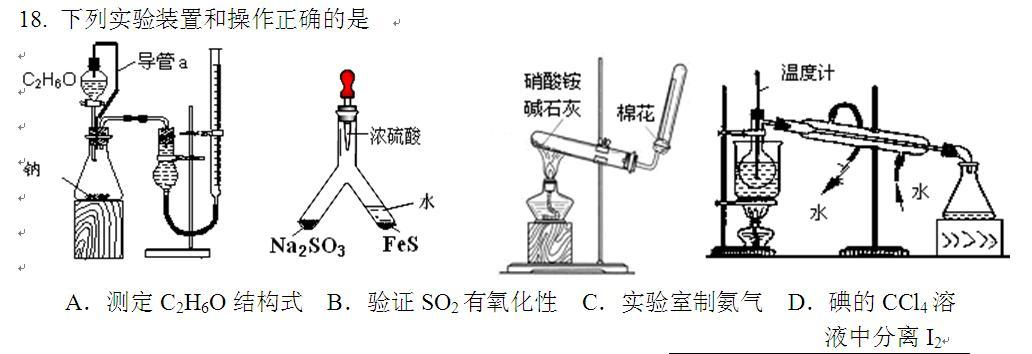
实验室制氨气
(1)不能用NH4NO3跟Ca(OH)2反应制氨气
因为NH4NO3是氧化性铵盐,加热时低温生成NH3和HNO3,随着温度升高,硝酸的强氧化性发挥作用使生成的氨进一步被氧化生成氮气和氮的氧化物,所以不能用NH4NO3跟Ca(OH)2反应制氨气。
(2)实验室制NH3不能用NaOH、KOH代替Ca(OH)2
因为NaOH、KOH是强碱,具有吸湿性(潮解)易结块,不易与铵盐混合充分接触反应。又KOH、NaOH具有强腐蚀性在加热情况下,对玻璃仪器有腐蚀作用,所以不用NaOH、KOH代替Ca(OH)2制NH3。
(3)用试管收集氨气为什么要堵棉花
因为NH3分子微粒直径小,易与空气发生对流,堵棉花目的是防止NH3与空气对流,确保收集纯净。
(4)实验室制NH3除水蒸气为什么用碱石灰,而不采用浓H2SO4和固体CaCl2
因为浓H2SO4与NH3反应生成(NH4)2SO4
NH3与CaCl2反应也能生成其它物质
(5)实验室快速制得氨气的方法
用浓氨水加固体NaOH(或加热浓氨水)不可以
因为生成物有两种——co2和nh3
无法取得纯净的nh3
方程式是错的
你仔细看看caco3的碳元素跑哪了?
而且氮原子不守恒,前面有4个,后面就3个
正确的方程式:
2nh4no3+caco3===ca(no3)2+2nh3↑+co2↑+h2o
实验时制取氨气的方法:
2nh4cl+ca(oh)2===cacl2+2nh3+2h2o
希望我的回答对你有帮助,采纳吧o(∩_∩)o!





